维替泊芬(眼用光动力疗法光敏剂)
文章来源: 发布时间:2009-07-08 10:43:42 浏览次数:
|
光动力疗法光敏剂,通过光动力疗法治疗湿性老年性黄斑变性、病理性近视眼、眼组织胞浆病等导致的黄斑中心凹下脉络膜新生血管等引起视力持续恶化或丧失的疾病。治疗分两个步骤,同时需要药物和激光。第一步静脉输注维替泊芬,第二步用非热性二极管激光活化维替泊芬。
【药品名称】
通用名称:注射用维替泊芬
英文名称:Verteporfin for Injection
【成 份】本品活性成份为维替泊芬。化学名称:9-甲基(Ⅰ)和13-甲基(Ⅱ)反式-(±)-18-乙烯-4,4a-二氢-3,4-双(甲酯基)-4a,8,14,19-四甲基-23H,25H-苯卟啉-9,13-二丙酯
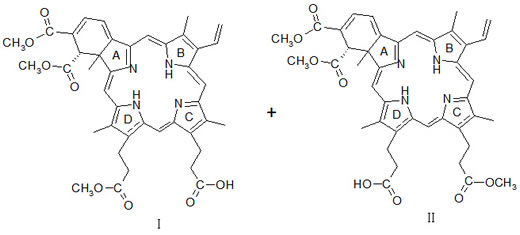
分子式:C41H42N4O8
分子量:718.8
【性 状】本品为深绿色疏松块状物。
【适 应 症】维替泊芬治疗适用于继发于年龄相关性黄斑变性,病理性近视或可疑眼组织胞浆菌病的,以典型性为主型中心凹下脉络膜新生血管形成的患者。
对于隐匿性中心凹下脉络膜新生血管为主的患者,尚无充分证据支持维替泊芬治疗。
【规 格】15mg(以维替泊芬计)
|
[--分页符--]
|
【用法用量】维替泊芬治疗分为两个步骤,同时需要药物和激光。第一步静脉输注维替泊芬,第二步用非热性二极管激光活化维替泊芬。
每隔3个月医生需要检查患者,一旦荧光血管造影出现脉络膜新生血管渗漏就应该重复治疗。
病灶大小判定
病灶最大线性距离(GLD) 通过荧光血管造影和彩色眼底像判定。各种典型和隐匿型CNV,出血和/或荧光遮挡,任何视网膜色素上皮浆液性脱离都应该进行判定。建议使用2.4~2.6倍的彩色眼底照相机。荧光血管造影片上病灶的GLD 必须经过相机放大率矫正,获得病灶在视网膜上的GLD。
光斑大小判定
治疗光斑大小应该比病灶在视网膜上GLD 大1000μm,留有500μm 的边缘,保证完全覆盖病灶。临床研究应用的最大治疗光斑为6400μm。
治疗光斑的鼻侧缘必须距离视乳头颞侧至少200μm,即使这样会在视神经200μm范围内出现CNV 光凝不足。
维替泊芬应用
每支维替泊芬用7ml 无菌注射用水配制成7.5ml 浓度为2mg/ml 的注射液。配制好的溶液必须避光保存,并且在4 小时内使用。建议在注射前观察配制好的溶液是否出现沉淀和变色现象。配制好的溶液是一种深绿色的透明液体。
按6mg/m2体表面积剂量配制维替泊芬,溶解于5%的葡萄糖溶注射液,配成30ml溶液。用合适的注射泵和过滤器,以每分钟3ml 的速度在10 分钟完全经静脉输注完毕。临床研究中应用的是1.2μm 的过滤器。
注意防止出现注射局部药液外渗。一旦发生要注意注射局部避光(详见注意事项)。
光治疗
自输注开始后15 分钟,用波长689nm 激光照射患者。
维替泊芬的光活化程度由所接受的激光总量决定。治疗脉络膜新生血管形成时,在病灶局部推荐使用激光剂量为50J/cm2,激光强度600mW/cm2。此剂量在83 秒内照射完毕。
激光剂量、激光强度、检眼镜的放大率和焦距的设置等都是合理激光治疗形成理想的激光斑的重要参数。具体的设置和操作见激光系统操作手册。
激光系统必须能产生波长在689±3nm能量恒定的光。激光通过光纤维、裂隙灯和一定放大倍率的检眼镜镜头在视网膜形成单一的圆形光斑。
以下激光系统已被证实与维替泊芬相匹配,能产生波长在689±3nm能量恒定的光。
由Lumenis Inc, Santa Clara, CA生产的科医人Opal Photoactivator 激光控制台和改良的科医人LaserLink adapter 适配器,由Carl Zeiss Inc., Thornwood, NY 生产的VISULAS 690s 激光和VISULINK PDT/U适配器。
双眼同时治疗
对照研究只允许每位患者治疗一只眼。如果患者双眼病灶都适合治疗,医生应权衡双眼同时治疗的利弊。如果患者以往有维替泊芬单眼治疗史,治疗的安全性已经得到证实,就可以采用一次注射维替泊芬治疗双眼。在注射开始后15 分钟,首先治疗病情进展较快的眼。在第一眼光照后立即调整第二眼治疗的激光参数,采用同第一眼相同的激光剂量和强度,在输注开始后不晚于20 分钟开始治疗。
如果患者首次出现双眼可以治疗的病灶,以往无维替泊芬治疗史,最好先治疗病情进展较快的眼。如果第一只眼治疗后1 周,未出现明显的安全性问题,可以采用第一眼的治疗方案,再输注维替泊芬进行第二只眼治疗。大约三个月后检查双眼,如果双眼病灶都出现渗漏,需要重复治疗,可以重新输注维替泊芬进行治疗。
【不良反应】
发生率
很常见(>1/10)、常见(>1/100至<1/10)、不常见(>1/1000至<1/100)、罕见(>1/10000至<1/1000)和极罕见(<1/10000)。
眼部异常
常见:视力障碍,如视力模糊、朦胧、失真或炫光症;视力降低:视野缺损,如灰色或黑色晕轮、暗点或黑斑。
在安慰剂对照的眼部Ⅲ期临床研究中,2.1%以维替泊芬治疗的患者在7天内出现严重的视力丢失(4行或更多)。在非安慰剂对照研究中只有少于1%的患者出现严重的视力丢失。受影响的主要是仅为陷匿性(4.9%)或轻微典型性的年龄相关性黄斑变性的患者。在安慰剂组中无此不良事件的报道。在大多数患者中,视力丢失是完全或者部分可逆的。
不常见:视网膜脱离(非孔源性)、视网膜下出血、玻璃体出血。
心脏
昏厥、血压和心率与超敏性相关的变化。
血管系统
血管迷走神经反应,高血压。
胃肠道异常
恶心
全身紊乱
不常见:药物输注导致的疼痛,主要为背痛,也可放射至其它部位如骨盆、肩带骨或肋骨;衰弱、发热。
皮肤
瘙痒症、感觉减退、光敏反应(2.2%的所有患者,1%的维替泊芬治疗患者),通常在治疗后的24小时内出现晒黑。如果患者遵循注意事项的指导,则可避免出现这些不良事件。
肌肉骨骼系统
接受维替泊芬药物输注的患者背痛发生率的增加与红细胞溶解或过敏反应无关。背痛通常在输注后短时间内缓解。
注射部位反应
常见:疼痛、水肿、发炎、渗出;
不常见:出血、变色、超敏性;
在临床研究和上市后监测的日常报告中的罕见不良事件(0.1%)包括:
眼部
影响视网膜或脉络膜血管的循环紊乱。
全身异常
血管迷走神经(治疗相关)和超敏反应,在个别病例中可能为重度。全身症状,例如胸痛、头痛、昏厥、出汗、头晕、皮疹、风疹、呼吸困难、热感和血压变化。
在病理性近视或视力组织胞浆菌病综合症的患者中报道的不良反应与在年龄相关性黄斑变性患者中报道和相似。 |
[--分页符--]
|
【禁 忌】维替泊芬治疗禁用于卟啉症患者、严重肝损伤患者及已知对本品制剂中任何成份过敏者。
【注意事项】
维替泊芬治疗的患者在药物输注后48小时内仍有光敏性(见【药物过量】)。在治疗后48 小时内患者应避免皮肤或眼部直接暴露于阳光或强的室内光源。如果患者在治疗后最初48小时内必须在白天去户外,必须穿保护性衣服,佩戴墨镜以保护全部皮肤和眼睛。日常室内光线是安全的。患者也不应完全处于黑暗状态,患者应暴露于周围的室内光线,这样可以加快维替泊芬从皮肤清除(“光漂白”)。 紫外线防护剂不能有效防止光敏反应。
维替泊芬在肝脏代谢并通过胆汁排出。对有中度至重度肝功能损害的患者要慎用维替泊芬治疗,因为目前尚无治疗这些患者的临床经验。
如果治疗后一周内视力严重下降4 行或以上的患者不能重复治疗,至少要在视力完全恢复到术前水平后再进行。治疗医生充分考虑潜在的治疗利弊。
在Ⅲ期临床研究的中期分析中,不能表明维替泊芬对隐匿性为主的年龄相关性黄斑变性患者有效。
药物输注应谨慎操作。维替泊芬的外渗,可导致严重的疼痛、发炎、注射部位肿胀或变色。疼痛缓解可能需要止痛治疗。如果出现药液外渗,必须立即停止输注并局部冷敷。外渗局部必须完全避光,直到局部肿胀和变色完全消失。
报道有胸痛、(治疗相关的)血管迷走神经反应,在个别病例中为重度。血管迷走神经和超敏反应可能与全身症状有关,例如昏厥、出汗、头昏、皮疹、呼吸困难、热感和血压及心率变化。在维替泊芬输注过程,应密切监测患者。
目前尚无在麻醉患者使用维替泊芬治疗的相关临床资料。在体外人体血液中,当浓度大约为患者预期血药浓度的5 倍时,出现轻度补体活化现象。在临床研究中没有报道临床相关的补体活化现象,但不能排除补体活化引起的过敏反应风险。因此在维替泊芬输注过程,应密切监测患者。当考虑在常规麻醉下进行维替泊芬治疗时须特别注意。
没有在不稳定心脏病(Ⅲ期或Ⅳ期)或未控制的动脉高血压患者中的临床经验。
【孕妇及哺乳期妇女用药】
妊娠
大鼠胎儿在器官发生期给予维替泊芬≥10mg/kg/天静脉注射(给予雌性大鼠,根据AUCinf值,大约为人6mg/m2暴露量的40倍剂量)。显示无眼畸形/小眼畸形的发生率增加。大鼠胎儿给予维替泊芬25mg/kg/天(给予雌性大鼠,根据AUCinf值,大约为人6mg/m2暴露量的125倍剂量),显示畸形肋/小眼畸形的发生率增加。
在妊娠期兔的器官发生期,给予维替泊芬10mg/kg/天静脉注射,出现体重增加的减少和进食减少现象。对母体毒性的不出现副反应剂量水平(NOAEL)为3mg/kg/天(大约是人按照体表面积6mg/m2暴露量的7倍)。在兔以10mg/kg/天剂量注射未出现致畸现象。
目前尚无对妊娠妇女的充分、良好对照的研究。只有当用药可能的益处远高于给胎儿带来的风险时,才考虑在妊娠期进行本品治疗。
哺乳期妇女
目前尚不明确注射维替泊芬是否会进入母乳。由于许多药物会进入母乳,哺乳期妇女进行维替泊芬治疗必须谨慎。
【儿童用药】尚无儿童用药的安全性和有效性结果。
【老年用药】在维替泊芬疗效临床研究中,维替泊芬治疗患者大约90%年龄在65岁以上。随着年龄增加,疗效逐渐减弱。
【药物相互作用】
目前尚无人体内维替泊芬药物相互作用的研究。
维替泊芬主要以原型通过肝脏快速排泄。药物代谢局限于肝和血浆酯酶。细胞色素P450 并不参与维替泊芬的代谢。
根据维替泊芬的作用机理,许多药物联合使用会影响维替泊芬的疗效。比如:钙通道阻断剂、多粘菌素B 或放疗会增加血管内皮细胞摄取维替泊芬。其他光敏剂(如四环素、磺胺类药物、酚噻嗪、磺脲类降血糖药、噻嗪类利尿药和灰黄霉素)可以增加皮肤光敏反应性。可以消除活性氧类或清除自由基的复合物,如二甲基亚砜、β-胡萝卜素、乙醇、甲酸盐和甘露醇可能会降低维替泊芬的活性。减少凝血、血管收缩和血小板聚集的药物如血栓素A2 抑制剂,也可以降低维替泊芬的疗效。
【药物过量】治疗眼药物和/或激光过量可以引起正常视网膜血管无灌注,引起持续严重的视力下降。药物过量可以延长患者对强光过敏的时间。建议一旦发生过量,需根据患者过量的程度成比例的延长避光时间。
【药理毒理】
作用机理
维替泊芬治疗分两步,需要注射维替泊芬和非致热红光源。
维替泊芬在血浆中主要被脂蛋白转运。在有氧环境下,维替泊芬一旦被光激活就会产生高度活性的、维持时间短暂的单氧和具有活性的氧自由基。被光激活的维替泊芬可以损伤局部新生血管内皮细胞,引起血管闭合。已知,受损的内皮细胞可以通过脂氧化酶(白三烯)和环氧化酶(类花生酸如血栓素)途径释放促凝因子和血管活性因子,引起血小板聚集纤维蛋白凝块形成和血管收缩。维替泊芬主要在新生血管包括脉络膜新生血管积聚,然而动物试验显示维替泊芬也出现于视网膜。因而在光动力学治疗的同时也会出现视网膜的损伤,包括视网膜色素上皮细胞和外核层。在人类,维替泊芬治疗引起脉络膜新生血管(CNV)暂时性闭合的疗效已经被荧光血管造影结果所证实。
致癌、致畸和对生殖功能的影响
目前还没有对维替泊芬致癌性的研究。
有报道,光动力治疗(PDT)可以引起DNA 损伤,包括DNA 链断裂,出现碱基敏感位点,DNA 降解和DNA-蛋白交联,从而引起染色体畸变、姐妹染色单体互换(SCE)和突变。另外,应用其他光动力学治疗药物后,经过可见光照射的中国仓鼠卵巢(CHO)细胞和经过近紫外光照射的中国仓鼠肺成纤维细胞出现姐妹染色单体互换的几率增加,在小鼠L5178 细胞突变和DNA-蛋白交联增加,在人恶性子宫颈癌细胞DNA 链断裂增加,而在正常细胞无此现象。在最后几个体系中,未对维替泊芬进行评估。PDT 治疗药物对DNA 的损伤作用对人类的潜在危险尚不清楚。
在大鼠每天静脉给予维替泊芬10mg/kg,(分别给予雄性和雌性大鼠,根据AUCinf值,人类6mg/m2暴露量的大约60 和40 倍剂量注射),未观察到对雄性或雌性大鼠生殖能力的影响。
【药代动力学】静脉输注维替泊芬后,维替泊芬以二指数形式清除,终末消除半衰期大约为5~6小时。剂量在6~20mg/m2之间时,暴露量和最大血药浓度均与注射剂量成比例。在一定的剂量范围内,药物的药代动力学参数不受性别影响。
维替泊芬经过肝和血浆酯酶代谢终产物苯卟啉衍生双酸。NADPH依赖的肝酶系统(包括细胞色素P450同工酶)不参与维替泊芬代谢。药物通过粪便排泄,只有不到0.01%的药物剂量可以在尿液中发现。
在一项轻度肝功能不全患者中(入选时有两项肝功能指标异常)进行的研究中,AUC和Cmax与对照组相比无明显差异,但是半衰期明显延长,大约增加20%。
【贮 藏】包装产品必须在室温下(25℃以下)避光保存。冻干粉针溶解后应避免光照,并在4小时内使用。 |

