

文章来源:张蕾 发布时间:2014-04-29 22:09:02 浏览次数:
华法林(Warfarin)是世界上应用最广泛的维生素K拮抗剂,主要通过抑制肝脏环氧化还原酶,使无活性的氧化型(环氧化物型)VK无法还原为有活性的还原型(氢醌型)VK,阻止VK的循环应用,干扰VK依赖性凝血因子II、VII、IX、X的羧化,使这些凝血因子无法活化,仅停留在前体阶段(有抗原,无活性),而达到抗凝的目的。华法林主要用于预防和治疗血栓栓塞性疾病,如人工瓣膜置换、静脉血栓形成(肺栓塞)、房颤等的口服抗凝治疗,以及降低心肌梗死复发及心肌梗死后血栓栓塞死亡的危险。新近大规模的流行病学临床试验已证实其在静脉血栓症的一级、二级预防,人工瓣膜置换和房颤全身栓塞的预防,急性心梗后全身栓塞预防和辅助治疗,以及再发心梗风险中的显著获益。作为重要的香豆素类口服抗凝药,华法林已经在临床使用超过 60年,2010年在美国的处方量超过2500万,与口服抗凝新药如达比加群(dabigatran)和利伐沙班(rivaroxaban)市场上只占有很少的份额相比,其地位无法替代,在可预知的未来仍然是口服抗凝药的主力军[1]。
由于华法林治疗窗较窄(有效治疗浓度2.2±0.4μg/mL)、个体间剂量差异较大(不同种族间及个体间达到适宜抗凝效果的稳定剂量差异可达10~20倍)、受药物食物影响较大,运用华法林抗凝治疗的同时,也成倍地增加了患者出血的发生率,甚至是危及生命,尤其是在治疗初期的数周到数月内。据估计,服用华法林的患者中,每年每100人中,平均有15.2人次发生出血副作用,其中致命性的大出血有3.5人次,因此华法林成为FDA药物不良反应检测系统最常报告的药物之一。目前,临床上多通过检测凝血酶原时间(经常用国际标准化比值INR表示)来监测抗凝状态(目标INR值为2~3),对患者进行华法林个体化用药指导,调整适宜的剂量[1];而大量研究证实华法林治疗初期(1~3个月)出血风险比稳定期高10倍以上,加上药物起效和失效缓慢,需要频繁检测患者INR,通过多次调整,经过很长时间的过高或者不足的抗凝才能达到最终适宜的稳定维持剂量。这些因素大大限制了其在临床的使用,尤其对那些急需抗凝(如房颤、人工瓣膜置换、静脉血栓形成)的患者,因此,仍有必要对其有效性和安全性给予更广泛的关注,需要临床医师深入全面了解华法林的药代动力学和药效动力学,药物基因组学、药物相互作用以及饮食影响,从而确定合适的治疗方案[2]。
华法林的化学结构为3-(a-苯基丙酮)-4-羟基香豆素,分子式为C19H15NaO4,是由S-华法林和 R-华法林组成的消旋体,其中S-华法林是R-华法林抗凝强度的3至5倍,主要在肝脏中被不同的细胞色素氧化酶(cytochrome P450,CYP)同工酶通过羧基化而代谢成非活性产物。目前已被证实有30多种基因相互作用决定华法林的代谢、转运和药理作用。患者不同的药物基因组学信息是导致华法林剂量差异的重要因素。因此在许多情况下,基因型是决定华法林达到最佳抗凝效果的关键变量。自从1999年人类第一次意识到基因多态性可能影响华法林剂量的个体差异以来,已有大量的关于细胞色素P450 2C9(CYP2C9)——主导S-华法林的代谢和维生素K环氧化物还原酶(VKORCI)——华法林的靶标蛋白基因突变与华法林剂量的研究,均证实这两个基因变异对获得适宜抗凝效果的华法林剂量有显著性影响,可以解释约35%的华法林剂量差异,结合临床因素(如年龄、性别、身高、体重、药物相互作用等)可以解释大于50%的剂量差异。
作为CYP450家族中的重要成员CYP2C9,是人类肝脏中最重要的药物代谢酶之一。而S-华法林在体内85%以上是由CYP2C9代谢转化为无活性的6-和7-羟化物。CYP2C9基因位于10q24.2,约50kb。其野生型等位基因CYP2C9*1,在不同的种族中的频率变异在80%到95%之间。在CYP2C9与华法林剂量相关性的研究中,CYP2C9*2 (C430T,rs1799853)和 *3 (A1075C,rs1057910)为研究较多的2个位点,这两种变异型的代谢能力较普通型下降约30%。Higashi等首次报道了CYP2C9基因分型和抗凝或出血之间的关联。其后,Sanderson等系统地研究表明CYP2C9*2或CYP2C9*3变异降低华法林的剂量,CYP2C9*3变异体的降幅更大(减少30%)。CYP2C9*2和CYP2C9*3的基因频率在不同人种和不同民族之间差异很大,国人的研究显示等位基因频率远远低于白种人的频率[3]。
VKORC1基因位于染色体16p11.2,约4.5kb,编码维生素K依赖性凝血因子生成的限速酶, 而维生素K环氧化物还原酶(VKORC)是华法林作用的靶点。多项研究均表明VKORC1多态性能显著影响华法林的使用剂量。Yuan等首次发现VKORC1启动子的多态性(-1639G>;A),所有华法林敏感者全是基因型为AA的纯合子,而华法林抵抗的个体其基因型为AG或GG。Veenstra等研究结果也提示VKORCl的变异可解释31%的维持剂量差异,而CYP2C9仅解释了7.9%的差异,该研究指出香港华人中VKORCl基因多态性是个体间华法林维持剂量差异的决定因素,而华人AA基因型频率比欧洲人高也可能是华人华法林维持剂量比欧洲低,对华法林更为敏感的主要原因[4]。
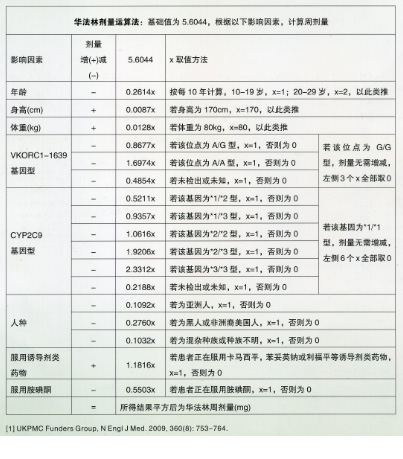
因此,CYP2C9基因*2,*3等位基因型和VKORC1基因G-1639A基因型与华法林抗凝疗效密切相关,不同基因型患者所需华法林剂量差异明显。美国FDA早在2007年修改了华法林的使用说明书,在警示部分标明CYP2C9和VKORC1遗传差异影响华法林的抗凝作用,建议在使用华法林前进行基因分型,以警示医生及患者个体的遗传差异可能影响其对药物的反应。将遗传因素与临床因素结合以指导华法林起始剂量的选择被认为是很有前景的一项应用[5-7]。2010年FDA修订华法林的药物处方信息,强调医疗服务的提供者应该给患者提供基因检测的机会,以便提高对患者个体化华法林剂量的初始评估,并且提供了基于CYP2C9和VKORC1基因分型的推荐剂量表。国际华法林药物基因组学联合会(The International Warfarin Pharmaeogenetics Consortium,IWPC)共搜集4大洲5700例使用华法林治疗的病人(其中包括华人在内的亚洲人1634例),证实在预测华法林稳定维持剂量方面,遗传药理学算法推荐的剂量优于常规的5 mg起始剂量[8]。目前,IWPC建立了华法林剂量公益网站(www.warfarindosing.org),向其中输入患者基因型和临床信息后,会自动计算出剂量(附剂量公式取值方法),此外,该机构还发布了单机版的excel计算表。美国Mayo Clinic临床医学中心的研究表明,与既往服用华法林未进行基因检测队列相比,服用华法林前对患者进行基因检测,其用药后总体住院率下降31%,因出血或血栓的总体住院率减少28%。临床药理学实践协会最近已推荐使用IWPC和Gage等算法作为研究遗传药理学指导华法林起始剂量选择的首选方法[9],近年来也多有文献报道基于中国人群构建的华法林剂量预测模型[10-12]。因此,在开始应用华法林时对患者进行基因型检测可以降低不良事件的发生率,从而改善应用华法林的安全性和有效性。
随着研究的深入及药物治疗模式的改变,临床上采取以药物基因组为基础实行华法林个体化治疗的时刻已经来临。在美国,CYP2C9、VKORC1基因多态性分析已经成为临床实验室的重要检测项目,临床实验室已经成为指导华法林个体化治疗的重要部门。在中国,开展CYP2C9&VKORC1基因检测已经纳入全国多个地区的医保目录,开始成为针对普通大众的医学诊疗服务内容之一,国内第一个CYP2C9&VKORC1基因检测试剂盒(上海百傲科技有限公司)于2012年获国家食品药品监督管理局批准(国食药监械(准)字2012第3401328号),已经在全国上百家医院如北京阜外医院、北京天坛医院、上海华山、上海瑞金、南京市鼓楼医院、济南市中心医院、沈阳军区总医院、大连市中心医院、福建省立、陕西西京、郑大附一正式开展临床应用。该项目的引进将有助于推动个体化诊疗的发展,也代表着未来临床药学的发展方向,有着重要的临床指导意义和使用价值。
(IWPC)剂量公式取值方法
参考文献
[1] Johnson JA. Warfarin pharmacogenetics: a rising tide for its clinical value. Circulation. 2012. 125(16): 1964-6.
[2] 陈琛, 丁虎, 崔广林, 汪道文. 基因检测与华法林的临床应用. 中国医学前沿杂志(电子版). 2012. (12): 5-7.
[3] 彭娟, 谭胜蓝, 周宏灏, 李智. 华法林药物基因组学和个体化用药. 中国药理学通报. 2013. 29(2): 169-172.
[4] 鲁晓春, 李世英. 中国人VKORC1基因多态性对华法林维持剂量影响的Meta分析. 心肺血管病杂志. 2012. 31(3): 259-263.
[5] Motsinger-Reif AA, Wagner MJ. Clinical trial evidence of the promise of pharmacogenomics warfarin dosing algorithms. Pharmacogenomics. 2012. 13(8): 861-3.
[6] Anderson JL, Horne BD, Stevens SM, et al. Randomized trial of genotype-guided versus standard warfarin dosing in patients initiating oral anticoagulation. Circulation. 2007. 116(22): 2563-70.
[7] Anderson JL, Horne BD, Stevens SM, et al. A randomized and clinical effectiveness trial comparing two pharmacogenetic algorithms and standard care for individualizing warfarin dosing (CoumaGen-II). Circulation. 2012. 125(16): 1997-2005.
[8] Klein TE, Altman RB, Eriksson N, et al. Estimation of the warfarin dose with clinical and pharmacogenetic data. N Engl J Med. 2009. 360(8): 753-64.
[9] Gage BF, Eby C, Johnson JA, et al. Use of pharmacogenetic and clinical factors to predict the therapeutic dose of warfarin. Clin Pharmacol Ther. 2008. 84(3): 326-31.
[10] Wei M, Ye F, Xie D, et al. A new algorithm to predict warfarin dose from polymorphisms of CYP4F2 , CYP2C9 and VKORC1 and clinical variables: derivation in Han Chinese patients with non valvular atrial fibrillation. Thromb Haemost. 2012. 107(6): 1083-91.
[11] Zhong SL, Yu XY, Liu Y, et al. Integrating interacting drugs and genetic variations to improve the predictability of warfarin maintenance dose in Chinese patients. Pharmacogenet Genomics. 2012. 22(3): 176-82.
[12] 余靓平, 宋洪涛, 曾志勇, 王齐敏, 邱罕凡. 基于药物基因组学的华法林给药模型的验证. 中华心血管病杂志. 2012. 40(7): 614-619.