

文章来源:国家自然科学基金委网站 发布时间:2015-01-23 20:46:52 浏览次数:
中国科学院生物物理研究所生物大分子国家重点实验室李国红研究员领导的研究团队研究发现,CENP-A 的第68 位丝氨酸对于CENP-A 正确装配到着丝粒上发挥重要作用。研究表明,有丝分裂早期Cdk1磷酸化CENP-A 的第68 位丝氨酸,该点磷酸化破坏了CENP-A 与HJURP 的结合,这样就阻止了有丝分裂退出期间CENP-A 过早地装配到染色体上。因为Cdk1活性在丝分裂退出期间是最小的, Cdk1/PP1a活性变化有利于CENP-A 的第68 位丝氨酸去磷酸化,这使HJURP介导CENP-A的着丝粒装配成为可能,从而完成了着丝粒区域染色质在子代细胞中的精确维持。该项研究深入解析了CENP-A丝氨酸68位动态磷酸化与其细胞周期依赖性的着丝粒装配存在和谐的联系,为我们进一步理解着丝粒表观遗传学调控提供了新视角。研究成果“Dynamic Phosphorylation of CENP-A at Ser68 Orchestrates Its Cell-Cycle-Dependent Deposition at Centromeres(丝氨酸68位动态磷酸化和谐地调控CENP-A细胞周期依赖性的着丝粒装配)”,在线发表于2014年12月31日的Developmental Cell(发育细胞)杂志上。同时,斯坦福大学的Aaron Straight教授为此文撰写了题为“Regulation the timing of CENP-A Nucleosome Assembly by Phosphorylation”的视点评论。此外,文章也被F1000prime推荐为“杰出”级论文。
该研究得到国家自然科学基金重大研究计划“细胞编程与重编程的表观遗传机制”培育项目和重点支持项目(91219202,91019007)等的长期资助。
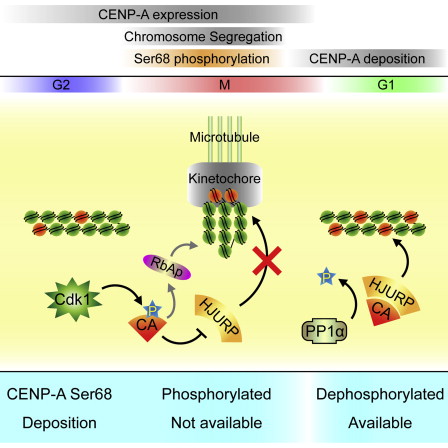
图例:CENP-A 丝氨酸68位的可逆磷酸化调控HJURP介导的CENP-A装配机制